今年年初,中国科学院上海生命科学信息中心、上海交通大学医学院等权威机构联合发布的报告显示,截至2024年底,我国登记的细胞治疗类临床试验项目达489项,居世界第二,第一位的美国为502项。
这是中国首次在一个新药研发领域走在国际前列。
“在中国提到细胞治疗,一定绕不开南京。”一位从美国归宁创业、在细胞治疗领域深耕10余年的企业负责人直言。
据公开数据,南京传奇生物科技有限公司的CAR-T细胞治疗产品卡卫荻®2024年销售额达9.63亿美元,而2024年全球CAR-T细胞疗法销售总额约45亿美元。据此计算,传奇生物产品市场占有率超20%。
南京驯鹿生物技术股份有限公司的产品福可苏®,为国内首款完全自主研发并全流程自主生产的CAR-T细胞治疗产品。目前,该产品已惠及超过10个国家和地区的数百名患者。
南京鼓楼医院风湿免疫科主任医师孙凌云,开创了异体间充质干细胞治疗新技术,2800余例重症红斑狼疮、系统性硬化症等免疫疾病患者受益。
近日,记者走进多家企业、医疗机构,一探这股一马当先的“细胞力量”究竟有多强。

幸运的“艾米莉”,新疗法诞生
美国女孩艾米莉·怀特海德在5岁时不幸罹患急性淋巴细胞白血病。到2011年,7岁的艾米莉在治疗缓解后病情再次复发。2012年,艾米莉迎来了自己的生机,费城儿童医院获批启动名为CAR-T的新型细胞疗法的临床试验,她成为首位接受CAR-T治疗的儿童白血病患儿,在曲折的治疗后,她最终获得了“临床治愈”。
这位幸运的女孩,每年都会在网络上更新自己的动态。在2024年5月的最新动态中,艾米莉留着金黄色的齐肩长发,看起来面色红润、身材健硕。她已无癌生活10余年,并考入宾夕法尼亚大学。
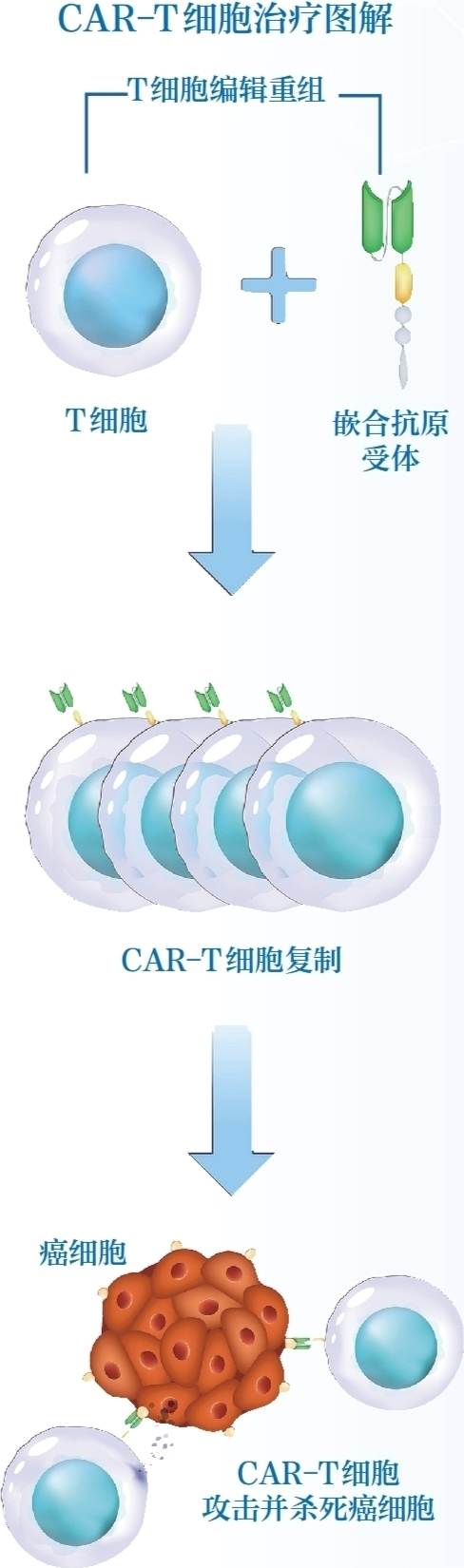
CAR-T的英文全称为Chimeric Antigen Receptor T-Cell Immunotherapy,一般被译为嵌合抗原受体T细胞免疫疗法。
T细胞,在人体免疫系统中扮演着维护健康、抵御疾病的关键角色。而T细胞衰竭是癌症患者免疫功能障碍的主要因素之一。CAR-T中的CAR(嵌合抗原受体)是人工合成的蛋白质,将它表达在T细胞上,就像是为T细胞配备了一部带着精准定位的小车,从而能识别特定抗原,消灭癌细胞。
艾米莉治愈6年后,一位中国女性成为首位接受CAR-T治疗的患者。2018年,该患者被确诊弥漫大B细胞淋巴瘤,经过多次化疗仍未控制住病情后,在医生建议下,她成为上海瑞金医院血液科CAR-T临床试验入组的第一名患者。
而她使用的药物,正是于2021年获批上市的中国首款CAR-T细胞治疗产品奕凯达®。
至今,全球已获批上市12款CAR-T细胞产品(传奇生物的卡卫荻在中美分别上市,总数不重复计算),中国上市6款,美国上市7款。当中就包括来自南京的驯鹿生物产品福可苏®和传奇生物产品卡卫荻®。
目前这些上市产品均为自体型CAR-T细胞治疗产品,也就是把患者自身T细胞提取分离,通过基因工程把CAR装在T细胞上,制成CAR-T细胞,再回输到患者体内。临床数据显示,在白血病、淋巴瘤等血液系统恶性肿瘤中,自体型CAR-T细胞治疗的整体缓解率高达80%以上。
此外,国内还有通用型CAR-T产品、干细胞治疗等治疗手段,在临床试验或临床治疗中已为癌症及免疫疾病患者带来福音。

“南京力量”,在竞速中领跑
就在不久前,国际制药巨头阿斯利康宣布斥资10亿美元收购比利时生物技术公司EsoBiotec,布局体内CAR-T等细胞疗法。去年12月,阿斯利康还以12亿美元收购一家中国CAR-T公司。一系列收购动作,让业界将较晚入局的阿斯利康称为“跑步”入场。巨头用行动表明,细胞治疗是值得重金投资的“黄金赛道”。
3月26日,香港大学医学院召开新闻发布会,宣布其教学医院香港玛丽医院成功完成全港首例CAR-T细胞治疗末期多发性骨髓瘤患者。
基于患者治疗需要,香港玛丽医院自去年下半年起,尝试通过香港指定患者药物使用计划(NPP)为多发性骨髓瘤患者应用驯鹿生物的伊基奥仑赛注射液。去年11月,首例香港NPP患者的单采血样从玛丽医院运送出,经南京禄口国际机场入境。之后,患者接受了驯鹿生物制备的伊基奥仑赛注射液回输治疗,一个月后,不仅取得显著疗效,且未出现严重并发症。
这一事件具有标志性意义,这是全国首个完成香港真实患者治疗全流程的CAR-T细胞治疗案例,也意味着伊基奥仑赛注射液成为全国首例成功实现跨境供药的国产CAR-T药品,打通了国产细胞治疗产品国际化探索路径。
2023年6月,驯鹿生物自主研发的CAR-T产品福可苏®(伊基奥仑赛注射液)获中国药监局批准上市,这是国内第3款上市的CAR-T细胞治疗产品,也是全球首个获批的全人源CAR-T产品。更为关键的是,此前上市的产品多为国际合作开发,福可苏是首款获批的中国企业自主研发并全流程生产的CAR-T产品,生产制备就在江北新区的生物医药谷。
国际权威期刊发表的研究数据显示,驯鹿生物伊基奥仑赛注射液在既往接受过三线及以上治疗的骨髓瘤患者的总体缓解率高达96%。基于其显著的临床疗效,公司正加速推进该CAR-T疗法用于二线与三线多发性骨髓瘤的前线治疗Ⅲ期临床研究。
“癌症治疗就像一场‘战役’,设有三道防线,视患者病情分为一线、二线、三线治疗。”驯鹿生物首席医学官陈杰博士介绍,在一线、二线治疗均未达到理想效果,患者病情持续恶化后,会启动三线治疗,这一阶段可能涉及新型靶向药物、免疫治疗等前沿手段,是在常规治疗效果不佳基础上的进一步探索。福可苏®的问世,让更多难治性多发性骨髓瘤患者看到了活下去的希望。
今年以来,新加坡、中国香港分别受理了驯鹿生物的CAR-T细胞产品上市申请。今年3月,中国澳门更是率先批准该款产品上市使用,这是伊基奥仑赛注射液首次在境外获得新药上市许可申请批准。如若更多上市申请在境外获批,“南京制备CAR-T细胞药”将广泛惠及全球患者。
2024年8月,传奇生物研发的细胞治疗产品卡卫荻®(西达基奥仑赛注射液)获得国家药品监督管理局批准上市,这是南京获批的第2款CAR-T细胞治疗产品。
该产品在2022年已获得美国食品药品监督管理局、日本厚生劳动省批准上市,并获得欧盟委员会附条件上市许可,近年来在国际市场上业绩亮眼。在传奇生物合作方强生发布的2025一季度财报中提到,二者合作开发的卡卫荻®产品一季度销售额为3.69亿美元,同比增长135%。
细胞治疗市场生机勃勃的背后,是积极开放的政策支持。早在2017年,原国家食品药品监督管理总局就发布了《细胞治疗产品研究与评价技术指导原则(试行)》,对细胞治疗产品按照药品管理相关法规进行研发时的技术要求进行了总体阐述;2022年,《“十四五”生物经济发展规划》将细胞治疗列为重点发展领域;2024年11月,国家药品监督管理局药品审评中心发布《细胞治疗产品临床药理学研究技术指导原则(试行)》,首次系统构建了细胞治疗产品的临床评价标准框架;2025年初,国务院办公厅颁布的全面深化药品医疗器械监管改革促进医药产业高质量发展的意见提出,为符合条件的细胞产品开辟审评绿色通道,将研发周期缩短30%以上。
近年来,全国多地发布政策举措,支持细胞治疗产业发展。江苏将细胞和基因技术产业纳入“10+X”未来产业体系,江北新区基因与细胞技术也在此前被列为全省首批未来产业先行集聚发展试点之一。
驯鹿生物制备产品为香港患者治疗的案例,即受益于江北新区利用自贸区制度优势,试点实施的多部门联合监管机制。该机制让生物试剂在宁进出口享有绿色通道,从血液样品落地到口岸查验,再到后续监管,整套流程可压缩至数小时内。

发力“通用型”,价格低更便捷
然而,自体型CAR-T产品在为患者带来生的希望的同时,依然面临诸多挑战,包括制备周期一般在2—3周、价格较昂贵等。目前,美国上市产品价格在40万美元左右,中国上市产品价格大幅下降,但定价最低的产品也要99.9万元人民币。同时,占肿瘤90%以上的实体瘤领域,还无CAR-T细胞产品上市。
让CAR-T产品更快更有效更可及,一些南京新锐企业带来了新希望。
去年,在北京和天津各有一位患者在临床试验中参与了CAR-T细胞治疗,濒危的病情得到扭转。两位患者分别患有食道癌骨转移和晚期胰腺癌,其中后者被称为“癌中之王”,是全球生存率最低的恶性肿瘤。他们在此之前经历了切除手术、放疗、化疗、靶向药等传统治疗手段,但都无法控制肿瘤的进展。
这两位患者的治疗产品均来自栖霞高新区的南京奇迹生物科技有限公司,是两款已进入科研临床阶段的通用型CAR-T产品。
记者“全副武装”进入奇迹生物的制备车间,探寻通用型CAR-T产品的奥秘。在一间洁净室外,透过明亮的玻璃墙,记者看到一排如双开门冰箱一样的设备整齐摆放。这是智能化冻存设备,里面存放的正是用于制备通用型CAR-T产品的“关键原材料”——健康T细胞。
“通用型CAR-T细胞疗法,是从健康捐献者体内分离提取T细胞,再通过基因编辑或体外扩增后,输入病患体内治疗。”奇迹生物董事长兼首席科学家郭志刚博士介绍,通用型CAR-T产品像常规药品一样,可以随取随用,并且由于一次可制备成百上千份,费用预计比传统自体CAR-T降低两个数量级。
奇迹生物已将通用型CAR-T产品拓展至多种疾病领域,包括卵巢癌、胰腺癌、胆管癌、胃癌等实体肿瘤,T淋巴细胞瘤、AML等血液肿瘤,以及红斑狼疮、银屑病等自身免疫疾病。
2024年11月底,南京润宁润渝生物技术有限公司创始人周立博士带领团队落户江北新区生物医药谷,开始了通用型CAR-T疗法的研发和产业化布局。
仅仅几个月,润宁生物已开发出首款超级隐形通用型CAR-T产品RN1201,进入早期临床试验阶段,初步数据表明其在安全性与疗效上具有显著优势。
一家外省的合作医院,推荐一位已被下病危通知书的遗传高危患者试用润宁生物产品。治疗一周后,患者竟然腹部积水消失,并且能够正常进食,达到确诊以来的身体最好状态,影像学评估是VGPR(非常好的部分缓解)。受此鼓舞,周立和团队伙伴们正在加快研发和临床试验的步伐。
“4个月,我们将产品进行多次迭代升级,未来还会有新一代产品进入临床。”周立说,药谷为企业提供了“现成场地”,这里已经成功培育出一家细胞治疗企业,因规模扩大在园区另选它址。仅经历一个月的局部修改后,润宁生物就开始开展研发试验。
对于患者而言,通用型CAR-T产品的细胞来自健康供体,如何克服宿主排斥是一大难题。润宁生物研发的“隐身技术”,部分借鉴了肿瘤细胞的逃逸机制,让回输的通用型CAR-T细胞在逃逸状态下完成治疗使命。
周立介绍,通用型CAR-T属于现货型产品,成本和价格会大幅度下降,未来上市后,可以储存在医院随时取用。“我们到合作医院观察过临床治疗,使用通用型CAR-T产品与常规输液的操作方式一样,通过静脉注射10分钟左右就可完成,非常安全,或许未来在门诊就能获得治疗。”
润宁生物还计划将RN1201的适应症拓展至自身免疫病领域,同时推进其他管线产品,包括通用型产品RN1501与RN1601,以及针对实体瘤的RN1301,全面布局差异化治疗方案。

“研—医—产”合力,产业化加速
值得关注的是,目前上市的细胞治疗产品,都已打破了创新药所谓的“10个亿投入、10年时间以及不到10%的成功率”的现象。与开发传统化学药物或抗体药物相比,细胞治疗产品研发周期短、迭代速度快。
同时,国家卫健委研究起草的《医疗卫生机构开展研究者发起的临床研究管理办法》,于2021年开始试点,在2024年正式发布。在进入临床试验前,一众医疗卫生机构积极参与发起临床研究,让细胞治疗产品的创新速度再度加快。
如今,南京已成为颇有影响力的“细胞医药城”,拥有完整和成熟的细胞治疗产业链,涵盖从早期研发、CDMO、药理毒理评价、临床申报等各个环节,形成了以传奇生物、驯鹿生物等头部企业为引领,一批创新型企业蓄势待发的格局。这种“短链化”的产业特征,使得技术突破能够快速实现产业化转化。
“在南京,我们可以实现从实验室到病床的快速转化。基于研、医、产之间的紧密合作,奇迹生物最快能在3个月内完成产品迭代,这在国外至少需要18个月。”郭志刚说。上下游企业、科研机构与临床医院深度协同,南京企业展现出优秀的研发效率。以奇迹生物为例,以不到50人的团队,已成功研发CHT101和CHT102两款进入临床阶段的CAR-T产品,创造了行业瞩目的“性价比”。
有企业主重点提到,临床的力量不容小觑,开放的政策激活了医疗机构参与创新的热情,也鼓舞了一批勤奋的中国医生投身其中,一边治病,一边做科研,为推动细胞治疗的发展做出很大贡献。
只要有门诊排班,孙凌云一般都会在早上5点半到达鼓楼医院,7点半准时开诊,而下诊时间基本不确定,最晚到过11点半。常有患者从外地不远千里地赶来,孙凌云不忍让其等到第二天。
红斑狼疮为一种免疫疾病,系统性红斑狼疮可累及全身各脏器,难治性患者5年内死亡率高达50%。
2007年,孙凌云提出的异体间充质干细胞疗法还处于临床试验阶段,患者珊珊成为全球首例接受异体间充质干细胞移植的患者。当年,珊珊与另外一位病重女性通过移植重获新生,验证了孙凌云治疗方式的成功。随后,该疗法让1100余例难治性系统性红斑狼疮患者受益,再加上治疗的其他免疫疾病,受益患者达2800多人。
“近期,我们第一次使用CAR-T疗法为红斑狼疮患者治疗,马上就会有第二次、第三次。”谈起新治疗方案,孙凌云立马两眼放光。他说,治疗就像“打仗”,创新是最好的“武器”。
2020年,孙凌云带领团队尝试研发脐带间充质干细胞注射液,他把目光投向新药研发。“让技术变为新药,才有让更多患者受益的可能。”孙凌云介绍,狼疮性肾炎和系统性硬化症新药的二期临床研究在去年12月底已经完成入组,今年6月底将完成随访。
无论从CAR-T产品获批目录,还是从临床研究方面,都不难看出,细胞治疗赛道上,中美两国是竞速主力。开放的政策,专注勤奋的医生,务实拼搏的企业,让这场“黄金赛道”的竞速赛非常值得期待。
新华日报·交汇点记者 许雯斐 王丽华 徐晋













