精准锁定恶性肿瘤位置,将抗癌药物牢牢“绑”在肿瘤表面并“乖乖排队”,深入癌细胞内部将其“一网打尽”……一场借力肿瘤微环境的“精准驻留”革命,或将改写抗癌药物“有去难留”的历史。
近日,东南大学生物科学与医学工程学院梁高林教授、王睿研究员团队在国际著名学术期刊《Biomaterials》在线发表最新研究成果。该研究提出了一种“释放与捕获”新型药物递送策略,可以将化疗药物“锁定”在肿瘤部位,使其长时间发挥作用。该策略在小鼠乳腺癌模型中显著提升了化疗效果,目前团队已申请提交相关发明专利。
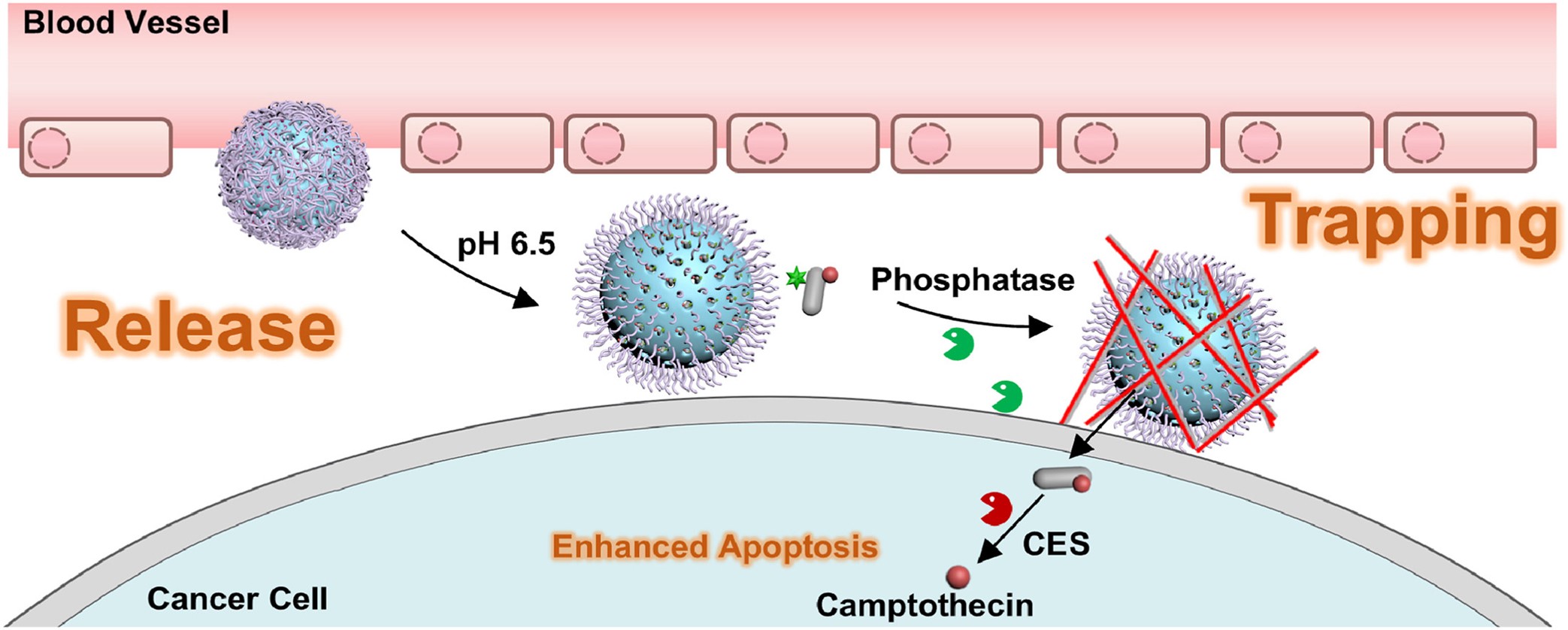
借助酸性微环境,实现精准“运送”
化疗是常见的癌症治疗手段,但传统的小分子化疗药物缺乏对肿瘤的靶向性,在全身扩散杀死癌细胞的同时也伤害健康细胞,这样的“无差别攻击”往往引发严重副作用。近年来,研究人员开发了许多基于纳米载体的药物递送系统,希望借助微型“药物卡车”将化疗药物更精准地递送至肿瘤病灶。
然而,这些纳米载体常常因无法与肿瘤细胞有效结合而从肿瘤组织中“溜走”,导致药物在肿瘤部位的实际滞留时间很短,靶向效率不理想。如何让运送到肿瘤病灶的药物“留得住、作用久”一直是纳米医学领域的一大挑战。
梁高林向记者介绍,通常情况下,健康人体的生理pH值维持在7.35~7.45的弱碱性区间,而癌细胞所处的微环境pH值则在6.5~7.0的酸性区间。利用肿瘤独特的生理环境,团队将一种对肿瘤微环境和酶双重响应的纳米药物,放入带有孔洞的“硅球”(介孔二氧化硅纳米载体),并在“硅球”表面覆盖壳聚糖以“堵住”孔洞,防止药物“泄漏”。“壳聚糖的特点在于,在正常碱性环境中会紧紧包裹住‘硅球’,而遇到肿瘤所在的酸性环境,壳聚糖会自动‘打开’,这样一来,‘硅球’就可以精准将纳米药物运送并释放在肿瘤周围。”
在很多研究中,能够完成将纳米药物释放到肿瘤周围这一步,治疗过程就已经结束,但此时“散落”着的纳米药物往往会“游走”到别处,仅有极少数可以真正被“吞入”癌细胞内部。而梁高林团队则是在精准“运送”纳米药物的基础上又实现了两个突破。
纳米药物“自排队”,“绑”住肿瘤
“以肝癌等碱性磷酸酶高表达的癌种为例,我们的创新点在于,纳米药物中有可以被碱性磷酸酶‘识别’的磷酸根,和酶结合后,剩下了包含传统化疗药物喜树碱的多肽前药。”王睿解释,多肽前药会迅速由透明状态转变为半透明果冻状,在癌细胞膜上原位进行“自组装”形成网状结构——犹如给肿瘤细胞表面涂上一层“黏胶”,无数被释放的多肽前药“自动排队”形成一层水凝胶,将整个‘硅球’、多肽前药和肿瘤牢牢“绑”在一起。
“这种‘自排队’实际上不难解释,就好像我们所熟悉的既亲水又亲脂的泡泡水,在我们吹泡泡时,泡泡水溶液‘自排队’形成了泡泡。”梁高林介绍,借助这样一个巧妙的设计,我们就成功将纳米药物牢牢“捕获”在癌细胞膜上,不让它们再“逃离”肿瘤组织。
在“硅球”中剩余的前药分子缓慢持续释放的过程中,多肽前药不断进行“自排队”形成水凝胶,并逐渐进入癌细胞内部。此时,团队又创新地利用癌细胞中的酯酶,将多肽与传统化疗药物“切割开”,最终将化疗药物留在癌细胞中。
“就好像为化疗药设计了一个‘圈套’,引导它一步步精准命中癌细胞。与传统化疗药物‘大水漫灌’式的作用方式不同,这种新型药物递送策略生物相容性好,安全性高,且能够有效避开正常细胞,大大降低了对人体正常组织的毒副作用。”梁高林介绍,细胞和动物实验表明,该纳米药物可以有效靶向病灶部位并长时间滞留,纳米载药利用率在5%~15%(传统纳米载药利用率不超过7‰)。
“酶响应”递药策略,为癌症治疗“量体裁衣”
除了碱性磷酸酶高表达的癌种,团队所研究的这种创新性递药策略能够依据不同的酶灵活更换不同底物,呈现出普适性,这也为众多癌症治疗方案的优化带来了可能。
去年初,梁高林教授团队与东南大学附属中大医院沈杨教授团队合作设计了一种九肽衍生物,利用“自组装”策略实现了卵巢癌的有效治疗。该文章成果已申请发明专利,该研究目前已得到了我省前沿引领技术基础研究重大项目等多项资助。
“针对不同癌种,我们要做的就是检索出其最活跃的酶,并根据这种酶设计出可以形成水凝胶的多肽前药(底物)。”梁高林告诉记者,此外,这种“自动排队”的模式也可以用于疾病诊断,即让诊断成像的探针在病灶部位“排队”,这也使得病灶部位的信噪比高于其他部位,可以帮助医生更精准地做出诊断。
王睿表示,未来,团队将进一步致力于这种“释放与捕获”新型药物递送策略的推广中。“为了更好地促进临床转化,我们更倾向于选用一些目前临床上已经成熟的药物载体,比如有孔洞的‘硅球’可以替换为目前临床上在用的脂质体。理论上来说,这种现有载体也可以实现药物的有效释放。”
新华日报·交汇点记者 谢诗涵
图片由受访者提供












